導(dǎo)讀
胃腸道包括一個復(fù)雜的生態(tài)系統(tǒng),腫瘤上皮細胞與基質(zhì)細胞、免疫細胞、神經(jīng)元細胞、膠質(zhì)細胞和其他細胞類型以及腸道內(nèi)的微生物和代謝物之間有大量的功能相互作用的機會。在這篇綜述中,研究者主要關(guān)注胃腸癌與中樞和腸神經(jīng)系統(tǒng)之間的相互作用。雖然這一方面以前的研究不足,但是近些年迅速興起的研究領(lǐng)域蓬勃發(fā)展,特別是對神經(jīng)在食管、胃、胰腺和結(jié)腸腫瘤的發(fā)展和進展中的作用有了更好的理解。癌癥神經(jīng)科學(xué)為促進研究者對神經(jīng)-癌癥相互作用是怎樣促進消化道腫瘤形成的理解提供了巨大的希望。由此產(chǎn)生的機制見解可用于識別診斷和預(yù)后生物標(biāo)志物,并開發(fā)新的治療干預(yù)措施。
原名:Exploiting unique features of the gut-brain interface to combat gastrointestinal cancer
譯名:利用腸-腦界面的獨特特征來對抗胃腸癌
期刊:The Journal of Clinical Investigation
IF:14.808
發(fā)表時間:2021.5
通訊作者:Jean-Pierre Raufman
通訊作者單位:馬里蘭大學(xué)醫(yī)學(xué)院
3 特定 胃腸道 癌與腸道神經(jīng)網(wǎng)絡(luò)的相互作用
人們越來越有興趣了解神經(jīng)元在非中樞神經(jīng)系統(tǒng)癌癥,特別是胃腸道癌癥的發(fā)生和發(fā)展中的作用。盡管如此,癌癥和神經(jīng)系統(tǒng)之間的許多相互作用是高度依賴于環(huán)境的。因此,食管、胃、胰腺和結(jié)腸神經(jīng)支配的差異會影響神經(jīng)元、神經(jīng)膠質(zhì)細胞和癌細胞之間的串?dāng)_。腸癌與腸道微生物群和其他糞便成分以及專門的腸道免疫系統(tǒng)的獨特接觸增加了復(fù)雜性。認識到這種腫瘤微環(huán)境的重要性引起了人們對“生態(tài)療法”的興趣,在這種療法中,滋養(yǎng)癌細胞的細胞被靶向以延緩癌癥的生長。解剖特征促進了神經(jīng)元、免疫細胞、腸道微生物和這一復(fù)雜生態(tài)系統(tǒng)的其他組成部分之間的相互作用,共同調(diào)節(jié)GI細胞的增殖、存活和侵襲(圖1)。腸神經(jīng)系統(tǒng)的神經(jīng)節(jié)集中在跨越整個胃腸道長度的肌間神經(jīng)叢和小腸和大腸的粘膜下神經(jīng)叢。腸神經(jīng)膠質(zhì)細胞位于固有肌層和粘膜中,特別是在正常腸隱窩的底部。除了為神經(jīng)元提供支持,數(shù)量超過神經(jīng)元的腸神經(jīng)膠質(zhì)細胞還積極參與各種ENS功能,包括對神經(jīng)元維持和存活至關(guān)重要的功能。和神經(jīng)元一樣,腸神經(jīng)膠質(zhì)表達神經(jīng)遞質(zhì)受體和轉(zhuǎn)運體,并對神經(jīng)遞質(zhì)作出反應(yīng),主要是通過調(diào)節(jié)細胞功能的細胞內(nèi)鈣的變化。腸神經(jīng)元和神經(jīng)膠質(zhì)根據(jù)它們在調(diào)節(jié)細胞結(jié)構(gòu)、神經(jīng)遞質(zhì)釋放、受體激活、電生理活性和其他功能特征中的作用進行分類;單細胞測序可以修改基于分子或遺傳特征的分類。圖1說明了結(jié)腸癌微環(huán)境中神經(jīng)-胃腸癌相互作用的廣泛框架——食道癌、胃癌和胰腺癌共有的特征(表1)。圖2放大了胃腸道癌細胞和腸道神經(jīng)/膠質(zhì)細胞網(wǎng)絡(luò)之間的關(guān)鍵相互作用。
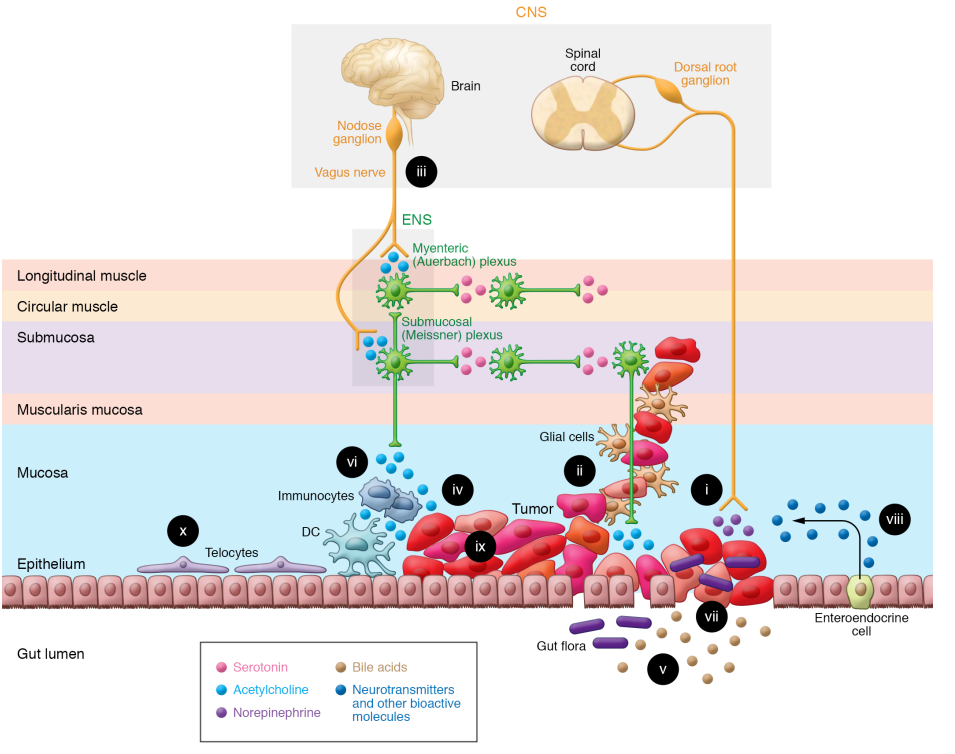
圖1. GI神經(jīng)元-癌癥界面。腸—腦軸調(diào)節(jié)GI癌癥進展的能力通過眾多元素之間的鄰近性性和多向串?dāng)_得到增強;這些復(fù)雜的相互作用為治療干預(yù)提供了可能。(i)癌細胞釋放神經(jīng)生長因子,促進神經(jīng)元趨向于腫瘤,增強對神經(jīng)遞質(zhì)、代謝物和神經(jīng)支架的獲取。晚期癌癥分期與增加的神經(jīng)密度相關(guān)。(ii)神經(jīng)周圍浸潤與更糟的結(jié)果相關(guān),為腫瘤擴散、獲得神經(jīng)遞質(zhì)和保護免受免疫攻擊提供了途徑。(iii)迷走神經(jīng)支配通過毒蕈堿機制刺激癌癥進展并調(diào)節(jié)免疫功能。(iv)神經(jīng)遞質(zhì),如乙酰膽堿,由神經(jīng)元、癌細胞、免疫細胞和可能的腸道細菌產(chǎn)生和釋放,刺激腫瘤生長、侵襲和傳播。(v) 腸道細菌修飾的排泄物膽汁酸通過多種機制調(diào)節(jié)免疫和癌細胞功能,包括激活癌細胞毒蕈堿受體。(vi)免疫細胞功能受ENS釋放的神經(jīng)遞質(zhì)以及癌癥、免疫和腸內(nèi)分泌細胞的調(diào)節(jié)。(vii) 癌癥領(lǐng)域腸道屏障的破壞允許調(diào)節(jié)免疫和神經(jīng)功能的微生物易位。(viii)響應(yīng)細菌和神經(jīng)輸入,遍布粘膜的腸內(nèi)分泌細胞釋放神經(jīng)遞質(zhì)和其他生物活性分子。(ix) 癌細胞顯示出腫瘤內(nèi)異質(zhì)性并過度表達神經(jīng)遞質(zhì)和生物活性分子的受體。(x)上皮下端細胞是腸道干細胞生態(tài)位促增殖信號的重要來源;盡管它們的位置很突出,但仍有待確定端粒細胞在神經(jīng)元-癌癥界面的功能作用。
表1. 胃腸道癌癥共有的神經(jīng)元-癌細胞相互作用的主要特征。

神經(jīng)生長因子。神經(jīng)生長因子或神經(jīng)營養(yǎng)因子,包含一個高度同源的前體蛋白家族,可切割成活性肽,包括神經(jīng)生長因子(NGF)、腦源性神經(jīng)營養(yǎng)因子(BDNF)、神經(jīng)膠質(zhì)細胞系源性神經(jīng)營養(yǎng)因子(GDNF)、神經(jīng)營養(yǎng)因子-3和神經(jīng)營養(yǎng)因子-4 (NT3和NT-4)(表2)。這些蛋白質(zhì)通過多種信號機制刺激神經(jīng)發(fā)育和存活;例如,神經(jīng)生長因子與原肌球蛋白酪氨酸受體激酶融合蛋白的結(jié)合刺激受體同二聚化、酪氨酸激酶結(jié)構(gòu)域的自磷酸化以及PI3K、Ras、磷脂酶C和其他下游效應(yīng)物的激活。表2. 與GI癌癥進展有關(guān)的神經(jīng)營養(yǎng)因子。

注:ACh,乙酰膽堿;Atg5,自噬相關(guān)基因5;BDNF,腦源性神經(jīng)營養(yǎng)因子;5-FU,5-氟尿嘧啶;GDNF,神經(jīng)膠質(zhì)細胞源性神經(jīng)營養(yǎng)因子;HO-1,血紅素加氧酶-1;M3R,M3毒蕈堿乙酰膽堿受體;NGF,神經(jīng)生長因子;NT,神經(jīng)營養(yǎng)因子;YAP,是相關(guān)蛋白。
早期癌癥釋放神經(jīng)營養(yǎng)因子,刺激局部神經(jīng)元生長和增加神經(jīng)密度,這些特征與更具侵襲性的癌癥相關(guān)。這些效應(yīng)是雙向的;癌癥釋放神經(jīng)營養(yǎng)因子,促進神經(jīng)發(fā)生、軸突生成和神經(jīng)遷移,而神經(jīng)元和膠質(zhì)細胞釋放神經(jīng)遞質(zhì),刺激腫瘤生長和侵襲(圖2)。在PDAC的起源中對此進行了廣泛的研究,其中腫瘤細胞釋放神經(jīng)營養(yǎng)生長因子(如神經(jīng)生長因子)及其受體在神經(jīng)元上的表達與神經(jīng)密度和腫瘤侵襲性相關(guān),這是鼠PDAC模型中神經(jīng)生長因子過度表達復(fù)制的機制。在轉(zhuǎn)基因小鼠PDAC模型中,手術(shù)切除腹腔和腸系膜上神經(jīng)節(jié)的神經(jīng)增強了化療效果,支持了中樞神經(jīng)系統(tǒng)輸入的重要性。鼠PDAC模型強調(diào)了神經(jīng)-癌癥相互作用的復(fù)雜性和特異性,其中胰腺的化學(xué)去神經(jīng)減輕了胰腺上皮內(nèi)瘤的形成和進展,但是迷走神經(jīng)切斷具有相反的作用。神經(jīng)侵襲和神經(jīng)支架。盡管定義各不相同,神經(jīng)周圍侵襲(PNI)通常被定義為癌癥侵入神經(jīng)鞘的三層中的任何一層,或至少包圍神經(jīng)周長的33%的癌癥;PNI影響腫瘤的生長、進展和對治療的反應(yīng)。PNI通過促進神經(jīng)細胞、神經(jīng)膠質(zhì)細胞和腫瘤細胞之間的生物化學(xué)和物理相互作用,促進神經(jīng)細胞和癌細胞的增殖,并刺激癌癥沿神經(jīng)平面擴散,從而促進癌癥的進展。盡管PNI與所研究的任何胃腸癌的更差臨床結(jié)果相關(guān),但區(qū)域性因素(如神經(jīng)密度)可能選擇性地增加某些癌癥相對于其他癌癥的PNI重要性。盡管從癌癥和免疫細胞向腫瘤微環(huán)境中釋放神經(jīng)生長因子和細胞因子很重要,但PNI背后的精確分子機制尚不確定。如圖1所示,癌微環(huán)境中的神經(jīng)元可以為GI的侵襲和轉(zhuǎn)移提供物理支架;據(jù)報道,癌細胞巢位于肌間神經(jīng)叢附近。癌細胞表達的關(guān)鍵表面分子(如L1CAM和N-鈣粘蛋白)促進了腸神經(jīng)元的粘附和遷移(圖2)。值得注意的是,沿ENS神經(jīng)元的逆行路徑可能包括腸道細菌,反映了神經(jīng)周圍癌支架,該支架為癌細胞、神經(jīng)元、膠質(zhì)細胞、免疫細胞和易位微生物之間的串?dāng)_提供了中樞。很少有實驗?zāi)P湍軌蚍从尺@種復(fù)雜的腫瘤微環(huán)境中細胞類型之間的多種相互作用。目前沒有針對PNI的治療。迷走神經(jīng)支配。盡管高度依賴于環(huán)境,但迷走神經(jīng)支配是CNS調(diào)節(jié)GI腫瘤的最突出方式。手術(shù)中斷迷走神經(jīng)(迷走神經(jīng)切斷術(shù))似乎可以降低患胃癌的風(fēng)險;胃神經(jīng)元密度與癌癥分期相關(guān)。在小鼠中,手術(shù)或藥理學(xué)半切斷術(shù)減弱前腫瘤Wnt信號并減少了失神經(jīng)胃中胃腫瘤的形成。值得注意的是,在小鼠PDAC模型中觀察到相反的效果,其中迷走神經(jīng)切斷術(shù)促進腫瘤形成。如下所述,這個難題可以通過M1和M3毒蕈堿受體(M1R和M3R)的差異表達來解釋對癌癥進展的作用相互矛盾。最后,通過逆行追蹤肝迷走神經(jīng)分支確定的肝-腦-腸神經(jīng)弧可能調(diào)節(jié)對CRC的免疫反應(yīng)。

圖2. 腫瘤微環(huán)境中普通GI癌細胞和神經(jīng)/膠質(zhì)細胞網(wǎng)絡(luò)之間的關(guān)鍵相互作用。(i) 乙酰膽堿 (ACh)的產(chǎn)生,由膽堿乙酰轉(zhuǎn)移酶(ChAT)介導(dǎo),刺激腫瘤生長、侵襲和傳播。癌細胞與神經(jīng)元產(chǎn)生的ACh的相對數(shù)量是不確定的。(ii) 從ENS中間神經(jīng)元釋放的血清素可能通過目前模糊的機制刺激結(jié)腸癌的生長。(iii) 從交感神經(jīng)元釋放的腎上腺素會刺激過度表達α-和β-腎上腺素能受體(βAR)的GI癌細胞的進展。(iv) 作為對神經(jīng)遞質(zhì)的反應(yīng),神經(jīng)膠質(zhì)細胞在調(diào)節(jié)和支持神經(jīng)元-癌細胞界面方面發(fā)揮著重要作用。神經(jīng)膠質(zhì)細胞還會產(chǎn)生腫瘤生長因子并將其釋放到腫瘤微環(huán)境中。(v) GABA通過過度表達的GABA受體(GABAR)刺激癌細胞增殖。(vi)癌細胞釋放的神經(jīng)生長因子(NGF、GDNF、BDNF、神經(jīng)營養(yǎng)因子)與神經(jīng)元受體(例如NTRK)相互作用以促進軸突生長和向腫瘤的趨向性。(vii) 癌細胞表達表面分子、L1細胞粘附分子(L1CAM)和N-鈣粘蛋白,促進沿著腸神經(jīng)元的粘附和遷移。同質(zhì)性相互作用使癌細胞上的L1CAM 粘附到神經(jīng)元上表達的L1CAM。(viii) 神經(jīng)元將關(guān)鍵代謝物(例如絲氨酸)釋放到腫瘤微環(huán)境中或重新編程癌細胞代謝途徑。(ix) ACh與PDAC上表達的煙堿膽堿能受體的相互作用刺激腫瘤進展。(x) 膠質(zhì)細胞和GI癌細胞之間的雙向相互作用涉及癌細胞衍生的白介素,其刺激前列腺素E2(PGE2)生物合成和腸神經(jīng)膠質(zhì)釋放旁分泌。PGE2通過EP4受體介導(dǎo)(EP4R介導(dǎo))的EGFR反式激活刺激腫瘤擴張。
癌細胞上的神經(jīng)遞質(zhì)及其受體。幾十年來,傳統(tǒng)的神經(jīng)遞質(zhì),如乙酰膽堿(ACh),被認為主要來自神經(jīng)元,如果不是唯一的話。在過去的15年里,人們越來越關(guān)注腫瘤微環(huán)境中的癌癥和免疫細胞以及腸道微生物群中的細菌產(chǎn)生和釋放的非神經(jīng)元神經(jīng)遞質(zhì)。在這方面,大多數(shù)研究涉及乙酰膽堿對GI表達的毒蕈堿受體的影響(圖3)。人胃癌和結(jié)腸癌細胞表達膽堿乙酰轉(zhuǎn)移酶(ChAT)并合成和釋放ACh。正常胰腺星狀細胞產(chǎn)生ACh,胰腺癌細胞表達膽堿轉(zhuǎn)運蛋白,這是ACh產(chǎn)生的替代標(biāo)志。然而,據(jù)作者所知,PDAC的乙酰膽堿生產(chǎn)尚未得到證實。釋放ACh的癌細胞類型通常過表達M3R,而M3R表達與胃癌分期和轉(zhuǎn)移相關(guān)。這一點及癌細胞釋放的ACh濃度相對較低,表明腫瘤微環(huán)境中的癌癥、簇狀細胞、免疫細胞和其他細胞非神經(jīng)元釋放神經(jīng)遞質(zhì),通過自分泌和旁分泌作用調(diào)節(jié)細胞功能。與這些觀察結(jié)果一致,小鼠CRC模型中的M3R缺陷減弱了瘤形成。正常腸上皮細胞中的α2A-腎上腺素能受體激活可能刺激EGFR反式激活和下游MEK/ERK信號,從而增強細胞遷移和傷口愈合。雖然腎上腺素能受體激活與PDAC進展有關(guān),但與毒蕈堿類神經(jīng)遞質(zhì)相比,腎上腺素能受體激動劑(如腎上腺素)在調(diào)節(jié)GI生長和進展中的作用仍相對未知。衡量神經(jīng)遞質(zhì)(從腫瘤微環(huán)境中的神經(jīng)元和癌癥、免疫者、腸內(nèi)分泌和其他細胞釋放的)的重要性受到對極低神經(jīng)遞質(zhì)濃度的精確空間和時間測量的挑戰(zhàn)的限制。此外,在體外評估神經(jīng)遞質(zhì)作用時,區(qū)分可能缺乏疾病相關(guān)性的生理學(xué)和藥理學(xué)(即超生理學(xué))神經(jīng)遞質(zhì)濃度至關(guān)重要。
 圖3. GI癌癥中的毒蕈堿受體激活。(A) 胃腺癌。(i) 從迷走神經(jīng)傳出的ACh釋放激活M3毒蕈堿受體(M3R);迷走神經(jīng)切斷術(shù)減輕腫瘤。(ii)癌細胞表達ChAT,這是非神經(jīng)元ACh合成的關(guān)鍵;由此產(chǎn)生的ACh水平及其自分泌和旁分泌對腫瘤進展的影響仍不確定。M3R激活誘導(dǎo)神經(jīng)生長因子(NGF) 表達。(B) PDAC。(iii)用氨甲酰甲膽堿(一種非亞型選擇性毒蕈堿受體激動劑)治療小鼠會激活毒蕈堿受體。(iv)M1R激活通過涉及抑制EGFR信號傳導(dǎo)的未定義機制減弱PDAC進展。(C) CRC。(v) M3R信號轉(zhuǎn)導(dǎo)EGFR;這是由MMP7介導(dǎo)的HB-EGF(一種EGFR配體)釋放介導(dǎo)的。(vi) M3R和EGFR的同時激活增強了靶基因表達。(vii) M3R激活選擇性地誘導(dǎo)MMP1、MMP7和MMP10表達。MMP1和MMP7促進細胞侵襲。MMP7還催化EGFR配體(例如HB-EGF)的釋放。(viii) M1R表達和激活通過未知機制減弱結(jié)腸癌進展。(ix) 免疫細胞和(x)腸道菌群提供了額外的非神經(jīng)元乙酰膽堿來源。(D) M3R后信號通過影響各種信號通路來改變基因表達和癌細胞功能。APC和/或β-catenin基因突變使β-catenin 免于蛋白酶體破壞,促進β-catenin靶基因的轉(zhuǎn)錄。APC和/或β-catenin基因突變使β-catenin 免于蛋白酶體破壞,促進β-catenin靶基因的轉(zhuǎn)錄。M3R激活可反式激活EGFR并增強β-連環(huán)蛋白信號傳導(dǎo)。由此產(chǎn)生的下游基因轉(zhuǎn)錄變化刺激癌細胞增殖、存活、遷移、侵襲和傳播。值得注意的是,神經(jīng)營養(yǎng)因子表達的誘導(dǎo)可以促進神經(jīng)生長和趨向性,這是一個反饋回路,提供額外的ACh和其他神經(jīng)遞質(zhì)。
圖3. GI癌癥中的毒蕈堿受體激活。(A) 胃腺癌。(i) 從迷走神經(jīng)傳出的ACh釋放激活M3毒蕈堿受體(M3R);迷走神經(jīng)切斷術(shù)減輕腫瘤。(ii)癌細胞表達ChAT,這是非神經(jīng)元ACh合成的關(guān)鍵;由此產(chǎn)生的ACh水平及其自分泌和旁分泌對腫瘤進展的影響仍不確定。M3R激活誘導(dǎo)神經(jīng)生長因子(NGF) 表達。(B) PDAC。(iii)用氨甲酰甲膽堿(一種非亞型選擇性毒蕈堿受體激動劑)治療小鼠會激活毒蕈堿受體。(iv)M1R激活通過涉及抑制EGFR信號傳導(dǎo)的未定義機制減弱PDAC進展。(C) CRC。(v) M3R信號轉(zhuǎn)導(dǎo)EGFR;這是由MMP7介導(dǎo)的HB-EGF(一種EGFR配體)釋放介導(dǎo)的。(vi) M3R和EGFR的同時激活增強了靶基因表達。(vii) M3R激活選擇性地誘導(dǎo)MMP1、MMP7和MMP10表達。MMP1和MMP7促進細胞侵襲。MMP7還催化EGFR配體(例如HB-EGF)的釋放。(viii) M1R表達和激活通過未知機制減弱結(jié)腸癌進展。(ix) 免疫細胞和(x)腸道菌群提供了額外的非神經(jīng)元乙酰膽堿來源。(D) M3R后信號通過影響各種信號通路來改變基因表達和癌細胞功能。APC和/或β-catenin基因突變使β-catenin 免于蛋白酶體破壞,促進β-catenin靶基因的轉(zhuǎn)錄。APC和/或β-catenin基因突變使β-catenin 免于蛋白酶體破壞,促進β-catenin靶基因的轉(zhuǎn)錄。M3R激活可反式激活EGFR并增強β-連環(huán)蛋白信號傳導(dǎo)。由此產(chǎn)生的下游基因轉(zhuǎn)錄變化刺激癌細胞增殖、存活、遷移、侵襲和傳播。值得注意的是,神經(jīng)營養(yǎng)因子表達的誘導(dǎo)可以促進神經(jīng)生長和趨向性,這是一個反饋回路,提供額外的ACh和其他神經(jīng)遞質(zhì)。
膽汁酸。膽汁酸(BAs)在肝臟中產(chǎn)生,排泄到腸腔中,并被腸道微生物群中的細菌修飾,通過肝腸循環(huán)再循環(huán)。BA 通過與Takeda G偶聯(lián)受體5(TGR5;GPBAR1)和M3毒蕈堿GPCR相互作用來調(diào)節(jié)正常和腫瘤性GI上皮細胞的功能(圖3)。BA與CRC風(fēng)險長期相關(guān),具有多效作用,包括腸道免疫調(diào)節(jié)和與CRC中過度表達的毒蕈堿受體的功能相互作用。這些功能相互作用模擬膽堿能神經(jīng)遞質(zhì)(例如 ACh)的相互作用,除其他作用外,還會導(dǎo)致EGFR的反式激活和刺激癌細胞增殖、存活和侵襲的信號轉(zhuǎn)導(dǎo)。有趣的是,鵝去氧膽酸還抑制脆弱擬桿菌毒素的致癌作用。腸道免疫細胞。通過調(diào)節(jié)淋巴流量、淋巴液流出和T細胞活化,CNS腎上腺素能神經(jīng)纖維抑制被神經(jīng)高度支配的GI器官如胃和胰腺的免疫活動。這可能會限制免疫監(jiān)視和檢查點抑制劑的功效;手術(shù)或化學(xué)去神經(jīng)支配可能會提高免疫治療的療效。ENS中的神經(jīng)元還調(diào)節(jié)腸道免疫細胞的活性,這些細胞在癌癥微環(huán)境中合成和釋放非神經(jīng)元ACh(圖3)。神經(jīng)內(nèi)膜中的巨噬細胞釋放細胞因子,通過將腫瘤細胞吸引到神經(jīng)元來促進PNI。最近發(fā)現(xiàn)的通過肝臟連接大腦和腸道的神經(jīng)弧可能通過涉及ACh神經(jīng)傳遞的機制調(diào)節(jié)對胃腸道癌癥的免疫反應(yīng)。腸道微生物組。腸道屏障的破壞會促進構(gòu)成腸道微生物群的細菌和真菌的透壁浸潤。由宿主-腸道微生物組界面的GI上皮細胞引起的癌癥打破了由正常上皮細胞之間緊密連接形成的單層屏障(圖1)。癌癥的“屏障破壞”效應(yīng)導(dǎo)致的生態(tài)失調(diào)可以激活多個信號系統(tǒng)。例如,NF-ĸB和STAT3通路調(diào)節(jié)區(qū)域免疫細胞和神經(jīng)元的功能。腫瘤會劫持這些發(fā)育、傷口愈合和抗炎信號程序來促進自身的進展。一些細菌代謝物,例如ACh和BAs,是GPCR激動劑,可以改變神經(jīng)元和癌細胞的功能(圖3)。CRC患者的粘膜微生物生物膜在小鼠模型中具有致癌性,一些細菌產(chǎn)物(例如脆弱擬桿菌毒素)有助于破壞癌癥的屏障作用。腸內(nèi)分泌細胞。分布在整個GI的上皮襯里(圖1),在神經(jīng)元、激素和旁分泌控制下的腸內(nèi)分泌細胞合成并釋放各種神經(jīng)遞質(zhì)。腸內(nèi)分泌細胞來源的血清素的旁分泌信號調(diào)節(jié)神經(jīng)元、免疫細胞和癌細胞的活動。ENS中腸內(nèi)分泌細胞或神經(jīng)元釋放的5-羥色胺是促進還是延緩GI癌癥進展仍不確定;這可能與環(huán)境和濃度有關(guān)(圖2)。與產(chǎn)生和釋放ACh的肺上皮神經(jīng)內(nèi)分泌細胞類似,ACh會刺激小細胞肺癌進展,嗜鉻細胞瘤等神經(jīng)內(nèi)分泌腫瘤可能會釋放神經(jīng)遞質(zhì)和生長因子,促進GI癌癥進展。代謝分子。癌細胞具有高代謝需求且限制供血。有研究表明,在這種營養(yǎng)耗盡的腫瘤微環(huán)境中,神經(jīng)元軸突可以為GI癌細胞提供稀缺的氨基酸和營養(yǎng)。Banh及其同事發(fā)現(xiàn),絲氨酸剝奪會損害PDAC的生長,但允許NGF的選擇性翻譯和分泌增加神經(jīng)密度,并為PDAC細胞提供軸突衍生的絲氨酸。Rabben等人發(fā)現(xiàn)胃癌是谷氨酰胺依賴性的;迷走神經(jīng)切斷術(shù)誘導(dǎo)代謝轉(zhuǎn)換從谷氨酰胺分解到氧化磷酸化和糖酵解(Warburg效應(yīng))。這些研究揭示了提供神經(jīng)元衍生代謝物和神經(jīng)元誘導(dǎo)的GI癌細胞代謝重編程作為潛在治療靶點(圖2)。3 特定胃腸道癌與腸道神經(jīng)網(wǎng)絡(luò)的相互作用GI癌的器官特異性特征——食管、胃、胰腺和結(jié)腸的神經(jīng)系統(tǒng)相互作用。在大多數(shù)情況下,區(qū)分一般性和真正的器官特異性特征有待進一步澄清。食管癌。食管癌由鱗狀細胞癌和腺癌組成;腺癌的激增證明了腸-腦軸對食管癌的影響,腺癌曾經(jīng)不常見,但現(xiàn)在是發(fā)達國家最常見的食管癌形式。胃食管反流,主要是由于對CNS(迷走神經(jīng)副交感神經(jīng)和脊髓交感神經(jīng))和ENS對食管下括約肌壓力和食管運動的控制少,所以易患癌前巴雷特上皮和食管腺癌。因此,盡管神經(jīng)元和神經(jīng)膠質(zhì)對食管癌進展的影響不如它們對其他胃腸道癌癥進展的影響那么明顯(表1),但有令人信服的證據(jù)表明神經(jīng)系統(tǒng)在食管腺癌的發(fā)展中起著核心作用。在其他機制中,神經(jīng)支配通過神經(jīng)營養(yǎng)因子及其受體促進食管腫瘤進展(表2)。神經(jīng)束和神經(jīng)肽免疫反應(yīng)性神經(jīng)纖維表達神經(jīng)營養(yǎng)受體激酶1(NTRK1,也稱為TrkA),一種NGF結(jié)合受體,常見于過表達NGF的食管癌;一種食管癌亞型高水平表達的Trk-T1神經(jīng)營養(yǎng)蛋白受體mRNA。在大約一半的187例食管鱗狀細胞癌中檢測到低親和力p75神經(jīng)營養(yǎng)因子受體(p75NTR),該受體在正常食管上皮細胞的干細胞群中表達。RNAi敲除食管鱗狀細胞癌細胞中p75NTR表達抑制增殖并誘導(dǎo)凋亡。值得注意的是,在食管癌、胰腺癌和結(jié)腸癌亞組中檢測到的涉及NTRK1、NTRK2或NTRK3的NTRK基因融合是FDA 批準(zhǔn)的兩種TRK抑制劑(entrectinib和larotrectinib)的靶點。PNI在大約一半的食管鱗狀細胞癌中發(fā)現(xiàn)了一個預(yù)后更差和生存率降低的臨床亞群。薈萃分析確定PNI是晚期食管和食管胃結(jié)合部癌的生物標(biāo)志物。PNI與晚期TNM分期、細胞分化差、無病生存期短和局部復(fù)發(fā)率增加相關(guān),這些因素與神經(jīng)生長因子的過度表達有關(guān)。胃癌。胃的近三分之二被迷走神經(jīng)廣泛支配,通過膽堿能機制調(diào)節(jié)胃酸和胃蛋白酶原的分泌。流行病學(xué)觀察表明膽堿能神經(jīng)支配與胃腫瘤之間存在聯(lián)系;神經(jīng)元密度與更晚期的胃癌相關(guān),消化性潰瘍病的迷走神經(jīng)切斷術(shù)可能會降低長期癌癥風(fēng)險。這種關(guān)聯(lián)的有力證據(jù)由鼠類研究提供,這些研究顯示手術(shù)或藥理學(xué)去神經(jīng)支配后胃腫瘤減少,對化療的反應(yīng)得到改善,生存期延長,其他研究結(jié)果證實了這一點。在這些小鼠模型中,迷走神經(jīng)切斷術(shù)減弱了β-catenin的核轉(zhuǎn)位和幾種Wnt/β-catenin靶基因的表達,包括Ccnd1、Axin2、Myc、Lgr5和Cd44,為去神經(jīng)支配的益處提供了一個合理的機制。至于其他胃腸道癌癥,M3R缺乏或抑制表明這種受體亞型的顯著作用。胃癌細胞表達ChAT,合成并釋放ACh,過表達M3R(圖2);M3R表達與胃癌分期和淋巴結(jié)轉(zhuǎn)移相關(guān),通過自分泌釋放ACh激活M3R,通過M3R/EGFR/ERK依賴機制刺激細胞增殖;M3R敲除抑制人胃癌細胞異種移植物的生長并促進其凋亡。在小鼠胃上皮細胞中,Dclk1陽性毛簇細胞和神經(jīng)元釋放的ACh通過YAP介導(dǎo)的機制(ACh/NGF/M3R/YAP軸)誘導(dǎo)NGF表達,促進神經(jīng)元增殖和癌癥進展(圖3A)。胰腺導(dǎo)管腺癌。神經(jīng)營養(yǎng)因子被PDAC和胰內(nèi)癌神經(jīng)元過表達;添加神經(jīng)營養(yǎng)因子以及PDAC和神經(jīng)細胞的共培養(yǎng)會刺激PDAC細胞增殖(表2)。外源性NGF劑量依賴性地提高MMP2表達并通過激活ERK信號增強胰腺癌細胞侵襲。胰腺癌過表達GDNF,這可能對腫瘤細胞具有化學(xué)動力學(xué)影響并上調(diào)MMP9的表達和活性。MMP9是一種明膠酶(IV型膠原酶),可促進癌細胞的侵襲和轉(zhuǎn)移。BDNF和NT-3也刺激PDAC侵入基底膜。腹膜后神經(jīng)解剖揭示PDAC中的神經(jīng)受累后,積累了強有力的證據(jù),將神經(jīng)輸入與癌癥進展聯(lián)系起來。神經(jīng)侵襲,幾乎一致存在于PDAC,縮短了生存期。神經(jīng)元支持和軸突引導(dǎo)基因突變也與PDAC進展有關(guān)。PDAC中罕見的RET突變與GDNF依賴性腫瘤侵襲相關(guān)(表2)。神經(jīng)遞質(zhì),如ACh、腎上腺素能激動劑、γ-氨基丁酸(GABA)和谷氨酸,從浸潤 PDAC的神經(jīng)元和神經(jīng)膠質(zhì)細胞網(wǎng)絡(luò)釋放,在腫瘤的生長和擴散中發(fā)揮重要作用。膽堿能信號通過毒蕈堿受體直接和間接抑制胰腺腫瘤發(fā)生和癌癥干細胞。在基因工程小鼠中,膈下迷走神經(jīng)切斷術(shù)加速,毒蕈堿激動劑氨甲酰甲膽堿抑制PDAC發(fā)展;氨甲酰甲膽堿通過M1R依賴性機制提高存活率(圖3B),目前正處于早期臨床試驗階段。同樣,在鼠PDAC模型中,膈下迷走神經(jīng)切斷術(shù)促進了腫瘤生長并降低了存活率,但在缺乏TNF-α的小鼠中則不然。與非神經(jīng)元ACh產(chǎn)生一致,人和大鼠胰腺星狀細胞產(chǎn)生的ACh可能調(diào)節(jié)胰腺外分泌和腫瘤形成。PDAC中毒蕈堿受體信號傳導(dǎo)的特定下游靶基因仍然不確定(圖3B)。β-腎上腺素能信號介導(dǎo)了慢性壓力下觀察到的加速的PDAC生長和侵襲。在 PDAC的原位小鼠模型中,體內(nèi)光學(xué)成像顯示壓力誘導(dǎo)的神經(jīng)激活增加了腫瘤的生長和轉(zhuǎn)移。這些作用通過β-腎上腺素能信號的藥理學(xué)激活重現(xiàn),并被β-阻斷逆轉(zhuǎn),這也延長了動物的存活期。與對照組相比,揭示了慢性壓力下的PDAC小鼠具有更大的腫瘤和更短的壽命,β-受體阻滯劑的作用減弱。PDAC中的β-阻滯劑正在臨床試驗中進行評估。其他神經(jīng)遞質(zhì)和受體與PDAC進展有關(guān)。例如,主要抑制CNS神經(jīng)元興奮性的GABA出人意料地刺激PDAC細胞增殖。這些作用很可能是通過過表達的GABA受體π亞基介導(dǎo)的,該亞基通過升高細胞內(nèi)鈣和激活MAPK/ERK信號傳遞信號。根據(jù)煙草使用者PDAC風(fēng)險的增加,尼古丁衍生的亞硝胺4-(甲基亞硝胺)-1-(3-吡啶基)-1-丁酮,一種有效的誘變劑、致癌物和煙堿型乙酰膽堿受體激動劑,可誘導(dǎo)倉鼠的PDAC。侵襲性胰腺癌過度表達NMDA谷氨酸受體,當(dāng)被谷氨酸能神經(jīng)激活時,會刺激促生長信號通路。結(jié)直腸癌。CRC早期的神經(jīng)影響很明顯——結(jié)腸癌干細胞(CCSC)在腸神經(jīng)膠質(zhì)細胞網(wǎng)絡(luò)比在正常病變和CRC更密集的環(huán)境中增殖,腸神經(jīng)膠質(zhì)網(wǎng)絡(luò)表現(xiàn)出結(jié)構(gòu)異常;S-100β和膠質(zhì)纖維酸性蛋白免疫染色顯示更密集和更多分支的網(wǎng)絡(luò)以及與CRC細胞和相鄰神經(jīng)元密切相關(guān)的膠質(zhì)細胞(圖1和2)。神經(jīng)膠質(zhì)細胞和CRC細胞之間的雙向相互作用涉及CRC衍生的IL-1α/β刺激前列腺素E2(PGE2)生物合成和腸神經(jīng)膠質(zhì)細胞的旁分泌釋放(圖2)。PGE2通過EP4受體介導(dǎo)的EGFR反式激活刺激CCSC生長和擴增。IL-1激活腸神經(jīng)膠質(zhì)細胞可能通過對免疫細胞的影響來促進腫瘤發(fā)生,類似于炎癥性腸病中會增加CRC風(fēng)險的免疫細胞。在人類CRC細胞系、免疫缺陷小鼠和原代人類CRC細胞中,腸神經(jīng)膠質(zhì)刺激CCSC衍生腫瘤的數(shù)量和大小增加,將腸神經(jīng)膠質(zhì)確定為潛在的治療靶點。神經(jīng)元還通過充當(dāng)CRC細胞遷移和轉(zhuǎn)移的物理支架來促進腫瘤發(fā)展(圖1)。ENS神經(jīng)元是獨特的無髓鞘;神經(jīng)束膜和神經(jīng)內(nèi)鞘層的缺失提供了與腫瘤和神經(jīng)膠質(zhì)細胞無阻礙的界面,這通過旁分泌信號使CCSC激活成為可能。腸神經(jīng)元和EpCAM陽性結(jié)直腸癌細胞密切相關(guān),尤其是在腫瘤浸潤前沿,促進了兩種細胞類型之間的物理相互作用(圖2)。細菌種類之間的協(xié)同相互作用與 CRC 的發(fā)生和進展有關(guān);在小鼠模型中,微生物(例如脆弱擬桿菌、大腸桿菌和具核梭桿菌)釋放因子,包括脆弱擬桿菌衍生的 BFT 毒素、有核梭桿菌衍生的FadA和Fap2粘附素,以及NF-κB,可增強 CRC 進展。這些因素很可能會調(diào)節(jié)ENS活動;例如,NF-κB在調(diào)節(jié)CNS炎癥中起著關(guān)鍵作用。腸道微生物組、CRC細胞和腸道神經(jīng)元之間的這些多向相互作用可能會促進癌癥進展;更有力的證據(jù)等待更好的實驗?zāi)P汀S捎诮Y(jié)腸某一區(qū)域的免疫、上皮和神經(jīng)細胞功能以及微生物多樣性的差異可能會影響其他部位的癌癥發(fā)展和進展,因此單純的簡化方法來探索微生物組、ENS和腫瘤形成之間的聯(lián)系可能會產(chǎn)生誤導(dǎo)。細胞表面分子(例如L1CAM和N-鈣粘蛋白)促進了CRC細胞粘附到腸神經(jīng)元并遷移到新的解剖位置的能力(圖2),并且可以通過神經(jīng)營養(yǎng)因子(例如,NT-4)進行調(diào)節(jié)(表2)。當(dāng)與原代腸神經(jīng)元、腸神經(jīng)膠質(zhì)和間充質(zhì)細胞共培養(yǎng)時,來自已建立細胞系的CRC細胞和原代CRC細胞與腸神經(jīng)元共定位。此外,與未轉(zhuǎn)化的腸上皮細胞和間充質(zhì)細胞相比,CRC細胞遷移更遠的距離以到達腸神經(jīng)元并以更大的力粘附于它們。通過膠原蛋白和基底膜的高阻力神經(jīng)鞘層成功侵入CRC細胞,可識別更堅固的細胞并賦予存活和增殖優(yōu)勢。除了PNI的預(yù)后價值外,單細胞基因分析還可以識別預(yù)測PNI和癌癥、神經(jīng)元和神經(jīng)膠質(zhì)基因的表達模式,從而提供治療機會。與胃癌和PDAC一樣,CRC中的膽堿能毒蕈堿受體是最突出的神經(jīng)遞質(zhì)靶標(biāo)。用非亞型選擇性毒蕈堿激動劑氨甲酰甲膽堿治療可促進小鼠結(jié)腸瘤形成。在五種毒蕈堿受體亞型中,M1R和M3R活性最顯著地調(diào)節(jié)結(jié)腸癌進展(圖3C)。M3R在原發(fā)性CRC中的過表達可預(yù)測轉(zhuǎn)移,在散發(fā)性和遺傳性CRC的小鼠模型中,整體M3R缺乏可有力地減輕腸道腫瘤。M3R激活選擇性地誘導(dǎo)MMP1、MMP7和MMP10的表達,從而促進CRC的侵襲和擴散。在體外阻斷MMP1的表達和激活可以消除ACh誘導(dǎo)的結(jié)腸癌細胞侵入內(nèi)皮細胞單層。選擇性BA(例如,脫氧膽牛磺酸)可以激活M3R,提供一種機制,由此增加的排泄物BA水平會增加小鼠結(jié)腸瘤形成。M3R在GI癌癥中的作用機制總結(jié)在圖3D中。與M3R相比,M1R在GI癌癥中的作用仍然不清楚。與PDAC的動物模型一樣,在氧化偶氮甲烷治療的小鼠中,M1R缺乏適度增加了結(jié)腸瘤形成,尤其是抵消了M3R缺失的有益影響。針對毒蕈堿受體信號傳導(dǎo)的治療策略可能需要同時靶向M1R和M3R。實驗性地捕捉復(fù)雜的腸-腦相互作用具有挑戰(zhàn)性。雖然簡化實驗系統(tǒng),如細胞共培養(yǎng),是解析交叉方向細胞信號的有價值的方法,但它們無法捕捉活生物體中復(fù)雜的環(huán)境和細胞間的相互作用。這些模型可能無法準(zhǔn)確反映神經(jīng)遞質(zhì)和其他生物活性分子的相關(guān)濃度、細胞外空間的擴散極限以及其他對區(qū)分生理和藥理作用很重要的參數(shù)(表3)。人類胃腸道具有特別復(fù)雜和動態(tài)的生態(tài)系統(tǒng),即使是體內(nèi)小鼠和其他動物模型也可能無法復(fù)制,這些動物模型也受到物種差異的干擾(圖1
)
。表3. 評估GI神經(jīng)-癌癥相互作用的實驗?zāi)P偷膬?yōu)點和局限性。
 注:AOM,氧化偶氮甲烷;DSS,葡聚糖硫酸鈉;FFPE,福爾馬林固定石蠟包埋;KC, (LSL -Kras+/LSL -G12D Pdx1-Cre);KPC,(LSL-Kras+/LSL -G12D LSL Trp53+/R172H Pdx1-Cre)。
注:AOM,氧化偶氮甲烷;DSS,葡聚糖硫酸鈉;FFPE,福爾馬林固定石蠟包埋;KC, (LSL -Kras+/LSL -G12D Pdx1-Cre);KPC,(LSL-Kras+/LSL -G12D LSL Trp53+/R172H Pdx1-Cre)。
技術(shù)限制和對質(zhì)量控制的關(guān)注不足—例如,確認抗體的特異性,特別是針對GPCR的抗體;驗證細胞系和轉(zhuǎn)基因小鼠;優(yōu)化組織固定、保存和自發(fā)熒光;并確保高質(zhì)量的mRNA測量—進一步影響數(shù)據(jù)質(zhì)量、解釋和翻譯價值。另一個挑戰(zhàn)是在體外、離體和體內(nèi)復(fù)制癌細胞對PNI和沿神經(jīng)支架遷移的物理力(圖1)。總的來說,這些限制導(dǎo)致了實驗?zāi)P驮陬A(yù)測臨床試驗中新型干預(yù)措施的治療成功方面的不良記錄,以及針對腸腦軸的治療缺乏。體外模型。大多數(shù)關(guān)于神經(jīng)遞質(zhì)對致癌細胞信號傳導(dǎo)和功能影響的信息來自體外細胞模型。這些使用相對較少的人類癌細胞系庫,其中許多是在幾十年前建立的。廣泛的傳代很可能改變了他們的基因組成和關(guān)鍵的生物學(xué)特征。使用原代胃腸道癌細胞可以解決這些問題,但受到不斷補充組織樣本和癌癥先天異質(zhì)性的限制。共培養(yǎng)原發(fā)性GI癌癥和ENS細胞提供了有用的信息,但不能完全捕獲復(fù)雜的體內(nèi)細胞相互作用。生物醫(yī)學(xué)期刊通常要求研究人員在多種癌細胞系中復(fù)制研究結(jié)果,但對這一指導(dǎo)的遵守情況并不統(tǒng)一;就在2018年,一項其他示例性研究僅使用了一種已建立的人類結(jié)腸癌細胞系,但沒有提供細胞系選擇的基本原理,盡管關(guān)鍵發(fā)現(xiàn)在原代人類結(jié)腸癌細胞中得到了復(fù)制。即使使用多個細胞系也不能保證在更復(fù)雜的系統(tǒng)中的科學(xué)有效性或可重復(fù)性,特別是考慮到缺乏來自腫瘤微環(huán)境的神經(jīng)和神經(jīng)膠質(zhì)成分的交叉輸入以及大量的腫瘤內(nèi)和神經(jīng)網(wǎng)絡(luò)多樣性。在某種程度上,單細胞RNA測序的使用可能會解決后一種限制,但必須通過定量PCR確認的基因表達變化不一定反映在蛋白質(zhì)表達的相應(yīng)變化中。離體模型。從GI癌癥干細胞開發(fā)的常規(guī)類器官模型可以提供有關(guān)促進生長、侵襲和轉(zhuǎn)移的因素的有用信息,但除其他限制外,類器官缺乏神經(jīng)和免疫元素。即使是允許在模擬基底膜的支架上生長小腸的新型3D類器官芯片,也未能結(jié)合神經(jīng)元件。這些限制可以通過組織工程來克服,以從更忠實地模擬體內(nèi)生物學(xué)的組織干細胞開發(fā)支架引導(dǎo)的類器官形態(tài)發(fā)生。除了進一步研究神經(jīng)元在胃腸道腫瘤中的作用外,越來越準(zhǔn)確的患者衍生類器官模型的開發(fā)可能會通過預(yù)測針對腸腦軸的新型療法的療效,為精準(zhǔn)醫(yī)學(xué)的進步鋪平道路。體內(nèi)模型。由注射到免疫缺陷小鼠皮膚中的人類癌細胞開發(fā)的異種移植物是常見的“體內(nèi)”模型。更諷刺的是,這些模型僅代表了從體外溶液到活生物體的培養(yǎng)基變化;異種移植實驗幾乎一致地反映了體外研究結(jié)果,而沒有提供新的機制見解,僅提供體外研究結(jié)果的增量進展和有限驗證。原位異種移植物可以更忠實地復(fù)制人類癌癥的進展和轉(zhuǎn)移,例如,植入小鼠乙狀結(jié)腸的人類結(jié)腸癌細胞。患者來源的異種移植物(PDX)可以提供實時信息以開發(fā)癌癥特異性治療。體內(nèi)模型通常無法解釋人類免疫和神經(jīng)細胞對胃腸道癌癥進展的影響,即使PDX模型采用“人性化”小鼠。腸道微生物群的變異也會混淆結(jié)果;應(yīng)避免僅基于小鼠研究的因果推斷。使用人體手術(shù)組織的研究人員通常使用鄰近的未受累組織作為對照,但即使使用距離癌癥10 cm或更寬的邊緣,也可能會被肉眼無法區(qū)分的癌癥“場效應(yīng)”影響“對照”細胞。構(gòu)成理解神經(jīng)-腫瘤相互作用基礎(chǔ)的神經(jīng)支配圖主要來自對非癌組織的研究,而GI癌癥可能會重組和重新連接神經(jīng)元網(wǎng)絡(luò)。手術(shù)操作的脫靶效應(yīng),例如迷走神經(jīng)切斷術(shù),可能會以意想不到的方式改變GI癌癥-神經(jīng)元界面。基因工程小鼠和豬在生理和病理生理學(xué)上受到基本物種差異的限制。例如,小鼠和人類的免疫系統(tǒng)具有非常不同的主要組織相容性基因。人源化基因工程小鼠模型潛伏期長,不能重現(xiàn)晚期人類疾病,這是最困難的臨床管理問題。即使結(jié)合先進的技術(shù)和模型,也無法忠實地模擬人類GI腫瘤微環(huán)境的復(fù)雜性。盡管取得了令人矚目的進展,但針對GI癌癥腸-腦軸的治療干預(yù)目前僅限于靶向神經(jīng)營養(yǎng)因子、毒蕈堿和β-腎上腺素能受體。為了推進該領(lǐng)域,需要更全面地了解GI神經(jīng)元-神經(jīng)膠質(zhì)-癌細胞界面,類似于腸道微生物組和免疫系統(tǒng)。適合探索的特定領(lǐng)域包括(a)確定胃腸道腫瘤分泌組的癌前變化如何改變腸神經(jīng)膠質(zhì)網(wǎng)絡(luò)并促進腫瘤發(fā)生;(b)使用單細胞RNA-Seq和空間轉(zhuǎn)錄組學(xué)來開發(fā)更完整的細胞、基因和蛋白質(zhì)清單,這些細胞、基因和蛋白質(zhì)包含腫瘤-神經(jīng)元粘附復(fù)合物和分子指導(dǎo)因子,并更好地了解它們的表達如何改變癌癥進展;(c)使用類似的方法來了解免疫細胞(例如腫瘤相關(guān)巨噬細胞)如何介導(dǎo)ENS和GI癌細胞之間的相互作用;(d)闡明GI癌癥如何吸引神經(jīng)元和 ENS 的其他成分,反之亦然;(e)探索像L1CAM這樣的分子,其表達與PDAC中的PNI相關(guān),是否是可行的治療靶點;(f)研究PNI是否為胃腸癌細胞提供逃避免疫檢測和治療的機制;(g)對增強癌細胞存活和生長的軸突衍生代謝物進行編目;(h)改進實驗?zāi)P停愿覍嵉夭蹲紾I腫瘤微環(huán)境的非凡復(fù)雜性以及神經(jīng)和神經(jīng)膠質(zhì)網(wǎng)絡(luò)的整合。利用組織制備、清除和更高分辨率光學(xué)成像方面的進步來解析CNS和ENS路徑,將帶來GI癌癥神經(jīng)科學(xué)中令人興奮的研究機會;用于單細胞mRNA測序和代謝組學(xué)的計算生物學(xué);光遺傳學(xué)利用光來監(jiān)測和控制單個神經(jīng)元的活動以及通過基因編輯修改的生化途徑;3D電生理記錄;和人工智能。整合新發(fā)現(xiàn)的細胞類型和信號通路將產(chǎn)生新的機制見解和治療目標(biāo)。例如,上皮下端細胞為整個小腸和結(jié)腸的干細胞提供促增殖信號,可能有助于結(jié)腸癌干細胞與腫瘤微環(huán)境成分之間的串?dāng)_(圖1)。填補知識中的關(guān)鍵空白具有巨大的潛力,可以促進我們對腸腦軸在胃腸道癌癥進展中的作用的理解,并使我們能夠利用這些信息來改善治療結(jié)果。由于共享途徑和機制(圖2和圖3D),針對一種胃腸道癌癥的腸腦連接的新型療法可能適用于其他癌癥。









